Les collisions sont parfaitement élastiques ; lorsque deux molécules entrent en collision, elles changent de direction et d’énergie cinétique, mais l’énergie cinétique totale est conservée. Les collisions ne sont pas “collantes”. L’énergie cinétique moyenne des molécules de gaz est directement proportionnelle à la température absolue.
Que se passe-t-il lorsque des molécules de gaz entrent en collision ?
Les particules de gaz sont dans un état constant de mouvement aléatoire et se déplacent en ligne droite jusqu’à ce qu’elles entrent en collision avec un autre corps. Les collisions présentées par les particules de gaz sont complètement élastiques ; lorsque deux molécules entrent en collision, l’énergie cinétique totale est conservée.
Lorsque des particules de gaz entrent en collision, qu’arrive-t-il à l’énergie ?
L’énergie cinétique peut être transférée d’une particule à une autre lors d’une collision élastique, mais il n’y a pas de changement dans l’énergie totale des particules en collision. Il n’y a pas de forces d’attraction ou de répulsion entre les particules de gaz.
Les molécules perdent-elles de l’énergie lorsqu’elles entrent en collision ?
Toutes les collisions entre molécules de gaz sont parfaitement élastiques ; toute l’énergie cinétique est conservée. Lorsque les voitures entrent en collision, l’énergie est perdue pour plier les pare-chocs et le métal. Les molécules n’agissent pas ainsi. Au lieu de cela, ils agissent comme des boules de billard.
Les particules de gaz perdent-elles la majeure partie de leur énergie lors d’une collision ?
Les particules de gaz entrent constamment en collision les unes avec les autres et avec les parois de leur contenant. Ces collisions sont élastiques ; c’est-à-dire qu’il n’y a pas de perte nette d’énergie due aux collisions. Les particules de gaz sont petites et le volume total occupé par les molécules de gaz est négligeable par rapport au volume total de leur contenant.
Qu’est-ce qui fait que les molécules de gaz se déplacent plus lentement ?
Étant donné que tous les gaz ont la même énergie cinétique moyenne à la même température, les molécules plus légères se déplacent plus rapidement et les molécules plus lourdes se déplacent plus lentement en moyenne. Théorie moléculaire cinétique des gaz (suite) ). Elle est proche (mais pas exactement identique) de la vitesse moyenne des molécules.
Laquelle des molécules de gaz suivantes a le libre parcours moyen le plus long ?
Ainsi, comme l’hydrogène a la plus petite masse molaire, il a donc le plus grand libre parcours moyen.
Les vrais gaz perdent-ils de l’énergie cinétique ?
Les particules de gaz sont en mouvement continu et aléatoire. Les collisions entre les particules de gaz sont complètement élastiques. En d’autres termes, il n’y a pas de perte ou de gain net d’énergie cinétique lorsque les particules entrent en collision. L’énergie cinétique moyenne est la même pour tous les gaz à une température donnée, quelle que soit l’identité du gaz.
Quand un gaz est idéal il n’y a pas de perte d’énergie lors des collisions ?
Les particules d’un gaz parfait n’exercent aucune force d’attraction les unes sur les autres ou sur leur environnement. Ainsi, les collisions présentées par les particules de gaz sont complètement élastiques ; lorsque deux molécules entrent en collision, l’énergie cinétique totale est conservée. Question 8 (1 point) Lorsqu’un gaz est idéal, il n’y a pas de perte d’énergie lors des collisions.
À quelle température les molécules n’ont-elles plus d’énergie et arrêtent-elles de bouger ?
À zéro kelvin (moins 273 degrés Celsius), les particules cessent de bouger et tout désordre disparaît. Ainsi, rien ne peut être plus froid que le zéro absolu sur l’échelle Kelvin.
Qu’est-ce qui détermine l’énergie cinétique moyenne des molécules d’un gaz ?
L’énergie cinétique moyenne des particules dans un gaz est proportionnelle à la température du gaz. Si elles se déplacent plus rapidement, les particules exerceront une plus grande force sur le récipient à chaque fois qu’elles heurteront les parois, ce qui entraînera une augmentation de la pression du gaz.
Comment s’appelle-t-on lorsque des particules de gaz frappent le mur ?
La théorie moléculaire cinétique peut être utilisée pour expliquer chacune des lois des gaz déterminées expérimentalement. Le lien entre P et n. La pression d’un gaz résulte des collisions entre les particules de gaz et les parois du récipient. Chaque fois qu’une particule de gaz frappe le mur, elle exerce une force sur le mur.
Qu’arrive-t-il aux particules de gaz lorsqu’un gaz est comprimé ?
Les gaz sont compressibles car la majeure partie du volume d’un gaz est composée de grandes quantités d’espace vide entre les particules de gaz. Lorsqu’un gaz est comprimé, comme lors du remplissage de la bouteille de plongée, les particules de gaz sont forcées à se rapprocher.
Quelle est la capacité des molécules de gaz à se propager rapidement ?
Les particules gazeuses sont en mouvement aléatoire constant. Les particules gazeuses ont tendance à subir une diffusion car elles ont une énergie cinétique. La diffusion est plus rapide à des températures plus élevées car les molécules de gaz ont une plus grande énergie cinétique. L’effusion fait référence au mouvement des particules de gaz à travers un petit trou.
La température affecte-t-elle l’énergie cinétique des molécules de gaz ?
Selon la théorie moléculaire cinétique, une augmentation de la température augmentera l’énergie cinétique moyenne des molécules. Comme les particules se déplacent plus rapidement, elles heurteront probablement plus souvent le bord du conteneur. L’augmentation de l’énergie cinétique des particules augmentera la pression du gaz.
Que se passe-t-il lorsque des particules de gaz parfait entrent en collision ?
Les particules de gaz sont dans un état constant de mouvement aléatoire et se déplacent en ligne droite jusqu’à ce qu’elles entrent en collision avec un autre corps. Les collisions présentées par les particules de gaz sont complètement élastiques ; lorsque deux molécules entrent en collision, l’énergie cinétique totale est conservée.
Lequel des énoncés suivants est correct pour la loi de Boyles ?
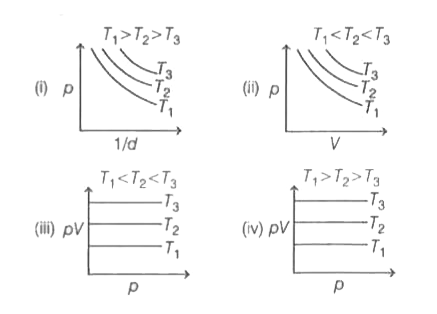 Par conséquent, les tracés (ii) et (iii) sont corrects. Par conséquent, l’option (d) est la bonne réponse.
Par conséquent, les tracés (ii) et (iii) sont corrects. Par conséquent, l’option (d) est la bonne réponse.
De quoi dépend l’énergie interne d’un gaz parfait ?
L’énergie interne et l’enthalpie des gaz parfaits ne dépendent que de la température, et non du volume ou de la pression. En appliquant des relations de propriété, il est prouvé que l’énergie interne et l’enthalpie des gaz parfaits ne dépendent pas respectivement du volume et de la pression.
Est-ce qu’un changement isotherme auquel un gaz parfait obéit?
L’expansion isotherme se poursuit tant que la force appliquée diminue et qu’une chaleur appropriée est ajoutée pour maintenir pV = 2. L’expansion est dite intérieurement réversible si le mouvement du piston est suffisamment lent pour qu’à chaque instant la température et la pression du gaz soient uniformes et conformes à la loi des gaz parfaits.
Quelles sont les cinq hypothèses d’un gaz parfait ?
La loi des gaz parfaits suppose que les gaz se comportent idéalement, c’est-à-dire qu’ils respectent les caractéristiques suivantes : (1) les collisions entre les molécules sont élastiques et leur mouvement est sans frottement, ce qui signifie que les molécules ne perdent pas d’énergie ; (2) le volume total des molécules individuelles est beaucoup plus petit
Que font les molécules de gaz lorsqu’elles perdent de l’énergie ?
La condensation se produit lorsque les molécules d’un gaz se refroidissent. Lorsque les molécules perdent de la chaleur, elles perdent de l’énergie et ralentissent. Ils se rapprochent d’autres molécules de gaz. Finalement, ces molécules se rassemblent pour former un liquide.
Quelles sont les 5 hypothèses de la théorie cinétique des gaz ?
Les cinq principaux postulats du KMT sont les suivants : (1) les particules d’un gaz sont en mouvement constant et aléatoire, (2) le volume combiné des particules est négligeable, (3) les particules n’exercent aucune force les unes sur les autres, (4) toutes les collisions entre les particules sont complètement élastiques, et (5) l’énergie cinétique moyenne de
Quel gaz a la valeur maximale du libre parcours moyen ?
Le libre parcours moyen est la distance moyenne parcourue par une molécule entre deux collisions successives. Évidemment, la molécule de plus petite taille moléculaire aura un plus grand libre parcours moyen. Par conséquent, le bon choix est (a), H2.
Quel est le libre parcours moyen d’une molécule ?
Le libre parcours moyen est la distance moyenne parcourue par une molécule en mouvement entre deux collisions.
Quelle est la valeur maximale du libre parcours moyen ?
Les molécules de petite taille possèdent un libre parcours moyen maximal.